Logam, dari bahasa Yunani Kuno μέταλλον (métallon) yang berarti 'tambang, tambang, logam', adalah bahan yang ketika baru disiapkan, dipoles, atau dipatahkan, menunjukkan tampilan yang berkilau, serta menghantarkan listrik dan panas dengan relatif baik. Logam biasanya ulet (dapat ditarik menjadi kabel) dan mudah dibentuk (dapat dipalu menjadi lembaran tipis). Sifat-sifat ini adalah hasil dari ikatan logam antara atom atau molekul logam. Logam dapat berupa unsur kimia seperti besi; paduan seperti baja tahan karat; atau senyawa molekuler seperti sulfur nitrida polimer.
Dalam fisika, logam umumnya dianggap sebagai zat apa pun yang mampu menghantarkan listrik pada suhu nol mutlak. Banyak elemen dan senyawa yang biasanya tidak diklasifikasikan sebagai logam menjadi logam di bawah tekanan tinggi. Sebagai contoh, yodium bukan logam secara bertahap menjadi logam pada tekanan antara 40 hingga 170 ribu kali tekanan atmosfer. Demikian pula, beberapa bahan yang dianggap sebagai logam dapat menjadi bukan logam. Natrium, misalnya, menjadi bukan logam pada tekanan di bawah dua juta kali tekanan atmosfer, meskipun pada tekanan yang lebih tinggi lagi diperkirakan akan menjadi logam lagi.
Dalam kimia, dua elemen yang seharusnya memenuhi syarat (dalam fisika) sebagai logam rapuh - arsenik dan antimon - biasanya dikenal sebagai metaloid karena sifat kimianya (sebagian besar non-logam untuk arsenik, dan seimbang antara logam dan non-logam untuk antimon). Sekitar 95 dari 118 elemen dalam tabel periodik adalah logam (atau kemungkinan besar adalah logam). Jumlahnya tidak tepat karena batas antara logam, bukan logam, dan metaloid sedikit berfluktuasi karena kurangnya definisi yang diterima secara universal tentang kategori yang terlibat.
Dalam astrofisika, istilah "logam" digunakan secara lebih luas untuk merujuk pada semua elemen kimia dalam bintang yang lebih berat daripada helium, dan bukan hanya logam tradisional. Dalam hal ini, empat "logam" pertama yang terkumpul di dalam inti bintang melalui nukleosintesis adalah karbon, nitrogen, oksigen, dan neon, yang kesemuanya merupakan unsur kimia non-logam. Sebuah bintang menggabungkan atom-atom yang lebih ringan, sebagian besar hidrogen dan helium, menjadi atom-atom yang lebih berat selama masa hidupnya. Dalam hal ini, metalitas suatu objek astronomi adalah proporsi materi yang terdiri dari unsur-unsur kimia yang lebih berat.
Logam, sebagai unsur kimia, menyusun 25% kerak Bumi dan hadir dalam banyak aspek kehidupan modern. Kekuatan dan ketahanan beberapa logam telah menyebabkan logam sering digunakan dalam, misalnya, konstruksi bangunan dan jembatan bertingkat tinggi, serta sebagian besar kendaraan, banyak peralatan rumah tangga, perkakas, pipa, dan rel kereta api. Logam mulia secara historis digunakan sebagai mata uang, tetapi di era modern, logam mata uang telah meluas ke setidaknya 23 unsur kimia.
Sejarah logam mulia diperkirakan dimulai dengan penggunaan tembaga sekitar 11.000 tahun yang lalu. Emas, perak, besi (seperti besi meteorik), timah, dan kuningan juga telah digunakan sebelum kemunculan perunggu yang pertama kali diketahui pada milenium kelima sebelum masehi. Perkembangan selanjutnya meliputi produksi bentuk awal baja; penemuan natrium-logam ringan pertama-pada tahun 1809; munculnya baja paduan modern; dan, sejak akhir Perang Dunia II, pengembangan paduan yang lebih canggih.
Properti
- Bentuk dan struktur
Logam berkilau dan berkilau, setidaknya ketika baru disiapkan, dipoles, atau dipatahkan. Lembaran logam yang lebih tebal dari beberapa mikrometer tampak buram, tetapi daun emas memancarkan cahaya hijau.
Keadaan padat atau cair dari logam sebagian besar berasal dari kapasitas atom logam yang terlibat untuk dengan mudah kehilangan elektron kulit terluarnya. Secara umum, gaya yang menahan elektron kulit terluar atom lebih lemah daripada gaya tarik-menarik pada elektron yang sama yang timbul dari interaksi antara atom-atom dalam logam padat atau cair. Elektron yang terlibat menjadi terdelokalisasi dan struktur atom logam dapat secara efektif divisualisasikan sebagai kumpulan atom yang tertanam dalam awan elektron yang relatif bergerak. Jenis interaksi ini disebut ikatan logam. Kekuatan ikatan logam untuk logam unsur yang berbeda mencapai maksimum di sekitar pusat deret logam transisi, karena unsur-unsur ini memiliki sejumlah besar elektron yang terdelokalisasi.

Batang logam dengan lubang yang dikerjakan dengan panas. Pengerjaan panas memanfaatkan kapasitas logam untuk mengalami deformasi plastis.
Meskipun sebagian besar logam unsur memiliki kepadatan yang lebih tinggi daripada kebanyakan bukan logam, terdapat variasi yang luas dalam kepadatannya, lithium menjadi yang paling tidak padat (0,534 g/cm3) dan osmium (22,59 g/cm3) yang paling padat. (Beberapa logam transisi 6d diperkirakan lebih padat daripada osmium, tetapi prediksi kepadatannya sangat bervariasi dalam literatur, dan bagaimanapun juga, isotop yang diketahui terlalu tidak stabil untuk dapat diproduksi dalam jumlah besar). Magnesium, aluminium dan titanium adalah logam ringan yang sangat penting secara komersial. Kepadatannya masing-masing 1,7, 2,7, dan 4,5 g/cm3 dapat dibandingkan dengan logam struktural yang lebih tua, seperti besi pada 7,9 dan tembaga pada 8,9 g/cm3. Dengan demikian, sebuah bola besi akan memiliki berat yang sama dengan tiga bola aluminium dengan volume yang sama.
Logam biasanya mudah dibentuk dan ulet, berubah bentuk di bawah tekanan tanpa membelah. Sifat ikatan logam yang tidak berarah dianggap berkontribusi secara signifikan terhadap keuletan sebagian besar padatan logam. Sebaliknya, dalam senyawa ionik seperti garam dapur, ketika bidang-bidang ikatan ionik meluncur melewati satu sama lain, perubahan yang dihasilkan di lokasi menggeser ion-ion dengan muatan yang sama lebih dekat, menghasilkan pembelahan kristal. Pergeseran seperti itu tidak teramati pada kristal yang terikat secara kovalen, seperti berlian, di mana terjadi fraktur dan fragmentasi kristal. Deformasi elastis yang dapat dibalik pada logam dapat dijelaskan oleh Hukum Hooke untuk memulihkan gaya, di mana tegangan berbanding lurus dengan regangan.
Panas atau gaya yang lebih besar dari batas elastisitas logam dapat menyebabkan deformasi permanen (tidak dapat dipulihkan), yang dikenal sebagai deformasi plastis atau plastisitas. Gaya yang diterapkan dapat berupa gaya tarik (menarik), gaya tekan (mendorong), atau gaya geser, tekuk, atau puntir (memutar). Perubahan suhu dapat memengaruhi pergerakan atau perpindahan cacat struktural pada logam seperti batas butir, kekosongan titik, dislokasi garis dan sekrup, patahan susun, dan kembar pada logam kristal dan non-kristal. Slip internal, creep, dan kelelahan logam dapat terjadi.
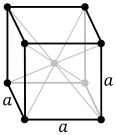
Struktur kristal kubik berpusat pada tubuh, dengan sel satuan 2 atom, seperti yang ditemukan pada mis. kromium, besi, dan tungsten.
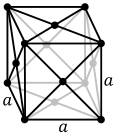
Struktur kristal kubik berpusat muka, dengan sel satuan 4 atom, seperti yang ditemukan pada mis. aluminium, tembaga, dan emas.
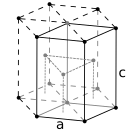
Struktur kristal padat heksagonal, dengan sel satuan 6 atom, seperti yang ditemukan pada mis. titanium, kobalt, dan seng.
Atom-atom zat logam biasanya tersusun dalam salah satu dari tiga struktur kristal yang umum, yaitu kubik berpusat pada tubuh (bcc), kubik berpusat pada muka (fcc), dan heksagonal rapat (hcp). Dalam bcc, setiap atom diposisikan di pusat kubus yang terdiri dari delapan atom lainnya. Pada fcc dan hcp, setiap atom dikelilingi oleh dua belas atom lainnya, tetapi susunan lapisannya berbeda. Beberapa logam mengadopsi struktur yang berbeda tergantung pada suhunya. Sel satuan untuk setiap struktur kristal adalah kelompok atom terkecil yang memiliki kesimetrisan keseluruhan kristal, dan dari situ seluruh kisi kristal dapat dibangun dengan pengulangan dalam tiga dimensi. Dalam kasus struktur kristal kubik berpusat pada tubuh yang ditunjukkan di atas, sel satuan terdiri dari atom pusat ditambah satu-delapan dari masing-masing delapan atom sudut.
- Listrik dan termal
Struktur elektronik logam berarti logam merupakan konduktor listrik yang relatif baik. Elektron dalam materi hanya dapat memiliki tingkat energi yang tetap dan bukan variabel, dan dalam logam tingkat energi elektron dalam awan elektronnya, setidaknya sampai tingkat tertentu, sesuai dengan tingkat energi di mana konduksi listrik dapat terjadi. Dalam semikonduktor seperti silikon atau bukan logam seperti belerang, terdapat celah energi antara elektron dalam zat dan tingkat energi di mana konduksi listrik dapat terjadi. Akibatnya, semikonduktor dan bukan logam adalah konduktor yang relatif buruk.
Logam unsur memiliki nilai konduktivitas listrik dari 6,9 × 103 S/cm untuk mangan hingga 6,3 × 105 S/cm untuk perak. Sebaliknya, metaloid semikonduktor seperti boron memiliki konduktivitas listrik 1,5 × 10-6 S/cm. Dengan satu pengecualian, elemen logam mengurangi konduktivitas listriknya ketika dipanaskan. Plutonium meningkatkan konduktivitas listriknya apabila dipanaskan pada kisaran suhu sekitar -175 hingga +125 °C. Logam adalah konduktor panas yang relatif baik. Elektron-elektron dalam awan elektron logam sangat mudah bergerak dan dengan mudah dapat meneruskan energi getaran yang diakibatkan oleh panas.
Kontribusi elektron logam terhadap kapasitas panas dan konduktivitas termalnya, serta konduktivitas listrik logam itu sendiri dapat dihitung dari model elektron bebas. Namun demikian, hal ini tidak memperhitungkan struktur rinci dari kisi ion logam. Dengan memperhitungkan potensial positif yang disebabkan oleh susunan inti ion, memungkinkan pertimbangan struktur pita elektronik dan energi pengikatan logam. Berbagai model matematis dapat diterapkan, yang paling sederhana adalah model elektron hampir bebas.
- Kimia
Logam biasanya cenderung membentuk kation melalui kehilangan elektron. Sebagian besar akan bereaksi dengan oksigen di udara untuk membentuk oksida dalam berbagai rentang waktu (kalium terbakar dalam hitungan detik, sementara besi berkarat dalam hitungan tahun). Beberapa yang lain, seperti paladium, platina, dan emas, tidak bereaksi dengan atmosfer sama sekali; emas bahkan membentuk senyawa yang mendapatkan elektron (aurida, misalnya caesium aurida).
Oksida logam sering kali bersifat basa, berlawanan dengan oksida nonlogam yang bersifat asam atau netral. Pengecualian sebagian besar adalah oksida dengan tingkat oksidasi yang sangat tinggi seperti CrO3, Mn2O7, dan OsO4, yang memiliki reaksi sangat asam; dan oksida dari logam yang kurang elektropositif seperti BeO, Al2O3, dan PbO, yang dapat menunjukkan sifat basa dan asam. Ini disebut oksida amfoter.
Pengecatan, anodisasi, atau pelapisan logam adalah cara yang baik untuk mencegah korosi. Namun, logam yang lebih reaktif dalam seri elektrokimia harus dipilih untuk pelapisan, terutama ketika lapisan diharapkan terkelupas. Air dan dua logam membentuk sel elektrokimia dan, jika pelapis kurang reaktif daripada logam yang mendasarinya, pelapis sebenarnya mendorong korosi.
Disadur dari: en.wikipedia.org