Etana (AS: /ˈɛθeɪn/ ETH-ayn, Inggris: /ˈiː-/ EE-) adalah senyawa kimia organik yang terjadi secara alami dengan rumus kimia C2H6. Pada suhu dan tekanan standar, etana adalah gas yang tidak berwarna dan tidak berbau. Seperti banyak hidrokarbon lainnya, etana diisolasi dalam skala industri dari gas alam dan sebagai produk sampingan petrokimia dari penyulingan minyak bumi. Penggunaan utamanya adalah sebagai bahan baku untuk produksi etilena. Senyawa terkait dapat dibentuk dengan mengganti atom hidrogen dengan gugus fungsi lain; gugus etana disebut gugus etil. Sebagai contoh, gugus etil yang dihubungkan dengan gugus hidroksil menghasilkan etanol, alkohol dalam minuman.
Sejarah
Etana pertama kali disintesis pada tahun 1834 oleh Michael Faraday, dengan menggunakan elektrolisis larutan kalium asetat. Dia mengira produk hidrokarbon dari reaksi ini sebagai metana dan tidak menyelidikinya lebih lanjut. Proses ini sekarang disebut elektrolisis Kolbe:
CH3COO- → CH3- + CO2 + e-CH3- + -CH3 → C2H6
Selama periode 1847-1849, dalam upaya untuk membuktikan teori radikal kimia organik, Hermann Kolbe dan Edward Frankland memproduksi etana dengan mereduksi propionitril (etil sianida) dan etil iodida dengan logam kalium, dan, seperti halnya Faraday, dengan elektrolisis asetat berair. Mereka salah mengira produk dari reaksi-reaksi ini sebagai radikal metil (CH3), di mana etana (C2H6) adalah dimer. Kesalahan ini dikoreksi pada tahun 1864 oleh Carl Schorlemmer, yang menunjukkan bahwa produk dari semua reaksi ini sebenarnya adalah etana. Etana ditemukan terlarut dalam minyak mentah ringan Pennsylvania oleh Edmund Ralds pada tahun 1864.
Properti
Pada suhu dan tekanan standar, etana adalah gas yang tidak berwarna dan tidak berbau. Etana memiliki titik didih -88,5 °C (-127,3 °F) dan titik leleh -182,8 °C (-297,0 °F). Etana padat ada dalam beberapa modifikasi. Pada pendinginan di bawah tekanan normal, modifikasi pertama yang muncul adalah kristal plastik, mengkristal dalam sistem kubik. Dalam bentuk ini, posisi atom hidrogen tidak tetap; molekul dapat berputar bebas di sekitar sumbu panjang. Mendinginkan etana ini di bawah suhu sekitar 89,9 K (-183,2 °C; -297,8 °F) akan mengubahnya menjadi etana metastabil monoklinik II (grup ruang P 21/n). Etana hanya sedikit sekali larut dalam air.
Parameter ikatan etana telah diukur dengan presisi tinggi dengan spektroskopi gelombang mikro dan difraksi elektron: rC-C = 1,528 (3) Å, rC-H = 1,088 (5) Å, dan ∠CCH 6 (5) ° dengan gelombang mikro dan rC-C = 1,524 (3) Å, rC-H = 1,089 (5) Å, dan ∠CCH = 111,9 (5) ° dengan difraksi elektron (angka-angka dalam tanda kurung menunjukkan ketidakpastian pada angka akhir)
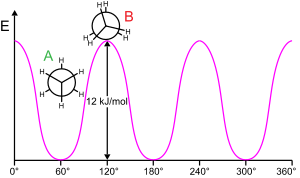
Etana (ditunjukkan dalam proyeksi Newman) merupakan penghalang rotasi pada ikatan karbon-karbon. Kurva merupakan energi potensial sebagai fungsi sudut rotasi. Penghalang energi adalah 12 kJ/mol atau sekitar 2,9 kkal/mol.
Memutar substruktur molekul pada ikatan yang dapat diputar biasanya membutuhkan energi. Energi minimum untuk menghasilkan rotasi ikatan 360° disebut penghalang rotasi. Etana memberikan contoh klasik dan sederhana dari penghalang rotasi tersebut, yang kadang-kadang disebut "penghalang etana". Di antara bukti eksperimental paling awal dari penghalang ini (lihat diagram di sebelah kiri) diperoleh dengan memodelkan entropi etana. Tiga hidrogen di setiap ujungnya bebas berputar di sekitar ikatan karbon-karbon pusat ketika diberikan energi yang cukup untuk mengatasi penghalang tersebut.
Asal usul fisik penghalang masih belum sepenuhnya jelas, meskipun tolakan tumpang tindih (pertukaran) antara atom hidrogen pada ujung molekul yang berlawanan mungkin merupakan kandidat terkuat, dengan efek stabilisasi hiperkonjugasi pada konformasi yang terhuyung-huyung berkontribusi pada fenomena tersebut.
Metode teoritis yang menggunakan titik awal yang tepat (orbital ortogonal) menemukan bahwa hiperkonjugasi adalah faktor terpenting dalam asal mula penghalang rotasi etana. Pada tahun 1890-1891, para ahli kimia menyarankan bahwa molekul etana lebih menyukai konformasi terhuyung-huyung dengan kedua ujung molekul yang miring satu sama lain.
Kimia
Kimia etana terutama melibatkan reaksi radikal bebas. Etana dapat bereaksi dengan halogen, terutama klorin dan bromin, melalui halogenasi radikal bebas. Reaksi ini berlangsung melalui penyebaran radikal etil:
C2H5- + Cl2 → C2H5Cl + Cl-
Cl- + C2H6 → C2H5- + HCl
Pembakaran etana melepaskan 1559,7 kJ/mol, atau 51,9 kJ/g, panas, dan menghasilkan karbon dioksida dan air sesuai dengan persamaan kimia:
2 C2H6 + 7 O2 → 4 CO2 + 6 H2O + 3120 kJ
Pembakaran juga dapat terjadi tanpa kelebihan oksigen, menghasilkan karbon monoksida, asetaldehida, metana, metanol, dan etanol. Pada suhu yang lebih tinggi, terutama pada kisaran 600-900 °C (1.112-1.652 °F), etilena merupakan produk yang signifikan:
2 C2H6 + O2 → 2 C2H4 + H2O
Reaksi dehidrogenasi oksidatif tersebut relevan dengan produksi etilena.
Produksi
Setelah metana, etana adalah komponen gas alam terbesar kedua. Gas alam dari ladang gas yang berbeda memiliki kandungan etana yang bervariasi dari kurang dari 1% hingga lebih dari 6% volume. Sebelum tahun 1960-an, etana dan molekul yang lebih besar biasanya tidak dipisahkan dari komponen metana gas alam, tetapi hanya dibakar bersama metana sebagai bahan bakar. Saat ini, etana adalah bahan baku petrokimia yang penting dan dipisahkan dari komponen gas alam lainnya di sebagian besar ladang gas yang telah dikembangkan dengan baik. Etana juga dapat dipisahkan dari gas minyak bumi, campuran gas hidrokarbon yang diproduksi sebagai produk sampingan dari penyulingan minyak bumi.
Etana paling efisien dipisahkan dari metana dengan mencairkannya pada suhu kriogenik. Ada berbagai strategi pendinginan: proses yang paling ekonomis yang saat ini digunakan secara luas menggunakan turboexpander, dan dapat memulihkan lebih dari 90% etana dalam gas alam. Dalam proses ini, gas yang didinginkan diekspansi melalui turbin, mengurangi suhu hingga sekitar -100 ° C (-148 ° F). Pada suhu rendah ini, gas metana dapat dipisahkan dari etana cair dan hidrokarbon yang lebih berat dengan distilasi. Distilasi lebih lanjut kemudian memisahkan etana dari propana dan hidrokarbon yang lebih berat.
Penggunaan
Penggunaan utama etana adalah produksi etilena (etena) dengan perengkahan uap. Ketika diencerkan dengan uap dan dipanaskan sebentar pada suhu yang sangat tinggi (900°C atau lebih), hidrokarbon berat terurai menjadi hidrokarbon yang lebih ringan, dan hidrokarbon jenuh menjadi tidak jenuh. Etana disukai untuk produksi etilena karena perengkahan uap etana cukup selektif untuk etilena, sedangkan perengkahan uap hidrokarbon yang lebih berat menghasilkan campuran produk yang lebih miskin etilena dan lebih kaya alkena yang lebih berat (olefin), seperti propena (propilena) dan butadiena, dan hidrokarbon aromatik.
Secara eksperimental, etana sedang diselidiki sebagai bahan baku untuk bahan kimia komoditas lainnya. Klorinasi oksidatif etana telah lama muncul sebagai rute yang berpotensi lebih ekonomis untuk vinil klorida daripada klorinasi etilena. Banyak proses untuk memproduksi reaksi ini telah dipatenkan, tetapi selektivitas yang buruk untuk vinil klorida dan kondisi reaksi yang korosif (khususnya, campuran reaksi yang mengandung asam klorida pada suhu lebih besar dari 500 ° C) telah menghambat komersialisasi sebagian besar proses tersebut. Saat ini, INEOS mengoperasikan pabrik percontohan etana-ke-vinil klorida berkapasitas 1000 t/thn (ton per tahun) di Wilhelmshaven, Jerman.
Demikian pula, perusahaan Arab Saudi SABIC telah mengumumkan pembangunan pabrik berkapasitas 30.000 t/ tahun untuk memproduksi asam asetat melalui oksidasi etana di Yanbu. Kelayakan ekonomi dari proses ini mungkin bergantung pada rendahnya biaya etana di dekat ladang minyak Arab Saudi, dan mungkin tidak kompetitif dengan karbonilasi metanol di tempat lain di dunia.
Etana dapat digunakan sebagai pendingin dalam sistem pendingin kriogenik. Dalam skala yang jauh lebih kecil, dalam penelitian ilmiah, etana cair digunakan untuk memvitrifikasi sampel yang kaya air untuk mikroskop kriogenik. Lapisan tipis air yang dengan cepat direndam dalam etana cair pada suhu -150 ° C atau lebih dingin akan membeku terlalu cepat sehingga air tidak dapat mengkristal. Metode pembekuan yang lebih lambat dapat menghasilkan kristal es berbentuk kubus, yang dapat mengganggu struktur lunak dengan merusak sampel dan mengurangi kualitas gambar dengan menghamburkan berkas elektron sebelum mencapai detektor.
Disadur dari: en.wikipedia.org